مفهوم اگزرژی(Exergy)و کاربرد اگزرژی در تحلیل سیستم
زمانی که قانون اول ترمودینامیک به عنوان اصل بقای انرژی بیان می شود، با کمیت اشکال مختلف انرژی سروکار داریم. از دیدگاه مهندسی یک کمیت انرژی دارای کیفیت است. در مجموع کیفیت به معنی درجه مفید بودن می باشد.
تغییرات در سیستم ها به وسیله عکس العمل های کار و گرما به وجود می آیند. مشاهدات قبلی نشان می دهند که عکس العمل کار بسیار مهم تر از عکس العمل گرما در تغییر حالت سیستم می باشد. از آن جایی که عکس العمل های کار درجه مفید بودن بالایی دارند گفته می شود که کیفیت بالاتری نسبت به عکس العمل های گرما دارند. حتی قانون دوم ترمودینامیک استاندارد بالاتری برای کار، نسبت به گرما، قائل می شود. کار به طور کامل به گرما تبدیل می شود اما تبدیل گرما به کار توسط دستگاهی که در یک سیکل ترمودینامیکی کار می کند، بسیار محدود است. بنابراین کار مفید تر از گرماست و به دست آوردن آن در برخی مواقع بسیار مشکل است.
در ترمودینامیک میتوان به هر سیستم، خاصیتی تحت عنوان انرژی داخلی نسبت داد که آن را با U نشان میدهند. با این فرض، قانون اول ترمودینامیک به صورت زیر بیان میشود:
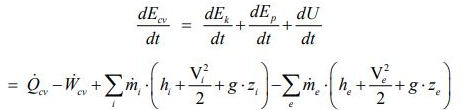
همچنین به منظور توضیح قانون دوم برای یک سیستم، خاصیتی تحت عنوان آنتروپی تعریف میشود. این خاصیت از جنس میزان انتقال حرارت صورت گرفته در واحد دما است. با استفاده از آنتروپی میتوان قانون دوم ترمودینامیک را در قالب فرمول زیر نشان داد.
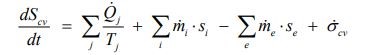
در کتب مختلف این دو خاصیت را به شکلهای گوناگونی بیان کردهاند. اما در حالت کلی میتوان مفهوم آنتروپی و انرژی داخلی را به صورت زیر ارائه داد.
- انرژی داخلی بیانکننده انرژی جنبشی و پتانسیل یک سیستم در مقیاس میکرو است. برای مثال در مقیاس اتمها و مولکولها، این انرژی را میتوان با استفاده از انرژیهای ارتعاشی، دورانی و انتقالیِ آنها توصیف کرد.
- آنتروپی معیاری از بینظمی سیستم محسوب میشود. از دیدگاهی علمیتر، این خاصیت بیانکننده تغییرات تصادفی سیستم است. در سالهای اخیر به جای بکار بردنِ اصطلاح «نظم و بینظمی» از عنوان «ناتوانی سیستم در تولید کار» استفاده میشود.
انرژی داخلی سیستم، نشأت گرفته از نوسانات مولکولی است.
اگزرژی را نیز میتوان با همین روش توصیف کرد. «Szargut» از عبارت زیر بهمنظور توصیف اگزرژی استفاده کرده است.
«به میزان کار قابل استخراج از یک سیستم که طی فرآیندی برگشتپذیر به حالت تعادل ترمودینامیکی خود رسیده است، اگزرژی گفته میشود.»
این تعریف نشان میدهد که چطور کار ایدهآلِ قابل استخراج از یک سیستم به خاصیت اگزرژی وابسته است. همچنین لازم است بدانید که رابطه مشخصی میان آنتروپی تولید شده یک سیستم و اگزرژی وجود دارد. در حقیقت تولید آنتروپی برابر با میزان اگزرژی از دست رفته است. آنتروپی، ناتوانی سیستم در تولید کار و اگزرژی توانایی سیستم در تولید کار را نشان میدهد.
برای نمونه تصور کنید که مقداری آب ۵۰ درجه در اختیار دارید. فرض کنید کل انرژی موجود در آن برابر با ۵۰ کیلوژول است. به نظر شما چه تفاوتی میان کیفیت انرژی آب مفروض و ۵۰ کیلوژول برق وجود دارد. واضح است که شما با استفاده از برق میتوانید هر کاری را انجام دهید اما با آب مورد نظر تنها میتوان استحمام خوبی را تجربه کرد! در واقع کیفیت انرژی در دو سیستم متفاوت است. از این رو اگزرژی ۵۰ کیلوژول برق بیشتر از ۵۰ کیلوژول آب است.
کیفیت انرژی یا اگزرژی گرما
قبل از اینکه در مورد توصیف ریاضیاتی اگزرژی صحبت کنیم، مثال زیر را در مورد میزان تبدیل گرما به انرژی مورد توجه قرار میدهیم.
همانطور که قبلا نیز گفتیم، بیان کلوین-پلانک میگوید نمیتوان از سیستمی کار گرفت، در حالی که تنها با یک منبع حرارتی مبادله انرژی دارد. در حقیقت این بیان به این معنی است که نمیتوان تمامی حرارت یک سیستم را به کار تبدیل کرد. شکلهای زیر دو حالتِ سیستمی را نشان میدهند که در یک سناریو، با یک منبع، تبادل حرارت دارد و در فرض دوم، با دو منبع مبادله انرژی میکند.
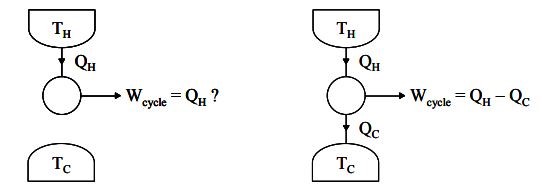
در حقیقت این بیان میگوید، سیستمی که با دو منبع حرارتی مبادله حرارت میکند، توانایی تولید کار تا سقف مشخصی را دارد. با توجه شکلهای بالا قانون اول ترمودینامک را میتوان به صورت زیر بیان کرد.
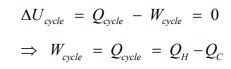
از طرفی قانون دوم بیان میکند که میزان کار استخراج شده از سیستم، در بازه زیر قرار دارد.
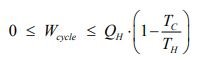
معادله بالا بیان کننده راندمان کارنو است که در حقیقت نشان دهنده بیشترین کار خروجی ممکن از سیستمی محسوب میشود که بین دو منبع حرارتی کار میکند. بنابراین آن را میتوان به صورت زیر تعریف کرد.
حال تصور کنید که منبعی با انرژی Q و دمای T در اختیار داریم. فرض کنید این منبع با محیط اطرافش که در دمای T۰ قرار گرفته، مبادله حرارت دارد. با استفاده از قانون دوم ترمودینامیک بیشترین کار خروجی از فرآیند مذکور را میتوان با استفاده از رابطه زیر بدست آورد.
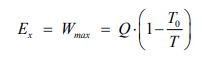
اگر به معادله بالا توجه کنید، میبینید که با افزایش دمای منبع، میتوان کار خروجی بیشتری از سیستم گرفت. بنابراین به نظر میرسد که دمای منبع در کیفیت انرژی موجود در آن تاثیر گذار است. شکل زیر همین مفهوم را نشان میدهد.
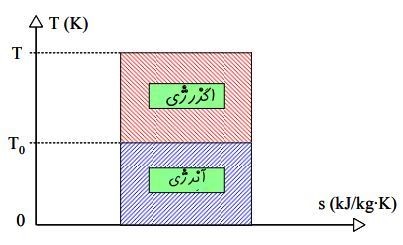
شکل بالا در نمودار T-S نشان داده شده، چرا که میزان انتقال حرارت در یک فرآیند برگشتپذیر را میتوان با استفاده از انتگرال زیر محاسبه کرد.
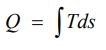
این نمودار بیان میکند که انرژی در حالت کلی به دو بخش تقسیم میشود.
۱. بخشی که قابلیت انجام کار را دارد.
۲. بخشی که نمیتوان از آن کار خروجی دریافت کرد که به آن «آنرژی» (Anergy) گفته میشود.
بنابراین برای منبعی با انرژی Q و دمای T که با محیط اطرافش که در دمای T۰ قرار گرفته، مبادله حرارت دارد، میتوان نوشت:
انرژی = اگزرژی + آنرژی
توجه کنید که گذاره بالا فقط در حالاتی برقرار است که انرژی در قالب حرارت منتقل میشود. برای مثال اگر بخشی از انرژیِ سیستم به صورت فشار سیال باشد، گذاره بالا الزاما صحیح نخواهد بود.
بیانهای اگزرژی
در حالت کلی سیستم فقط شامل انرژی حرارتی نیست و محاسبه اگزرژی به نسبت مشکلتر خواهد بود. در ادامه سیستمی را در نظر بگیرید که در آن جریانی با دمای T۱ و P۱ مبادله حرارتی با منبعی با دمای T۰ و P۰ دارد [این مبادله حرارت به صورت برگشتپذیر اتفاق میافتد]. در حالت ورودی از انرژی جنبشی و پتانسیلِ سیال صرف نظر شده است.
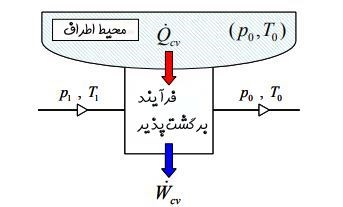
توجه داشته باشید که تمامی تحلیلها با این فرض انجام شده که ماکزیمم انرژی ممکن از سیستم گرفته شود چرا که فرآیند انتقال حرارت صورت گرفته میان محیط و سیال به صورت برگشتپذیر در نظر گرفته شده. جریان پس از مبادله حرارت با منبع بیرونی به دمای T۰ و P۰ میرسد و تمامی انتقال حرارت و کارِ صورت گرفته به صورت پایا است.
چنانچه در حوزه کاری خود به مشکلی برخورد کردهاید و در جستجوی فرد و یا شرکتهای توانمند برای حل مشکلتان هستید می توانید با عضویت در سامانه گلوپ و ثبت مشکل خود با این افراد و شرکت ها ارتباط برقرار کنید.
برای مشاهده مطالب بیشتر به گلوپ پلاس مراجعه فرمایید.










